Содержание:
В электрические проводники или проводящие материалыЭто те, которые имеют небольшое сопротивление циркуляции электрического тока, учитывая их специфические свойства. Атомная структура электрических проводников облегчает движение электронов через них, что способствует передаче электричества в элементах этого типа.
Проводники могут быть представлены в различных формах, одна из которых представляет собой материал в определенных физических условиях, например металлические стержни (стержни), которые не предназначены для включения в электрические цепи. Несмотря на то, что эти материалы не являются частью электрического узла, они всегда сохраняют свои проводящие свойства.

Существуют также однополярные или многополюсные электрические проводники, которые формально используются в качестве соединительных элементов для электрических цепей в жилых и промышленных помещениях. Этот тип проводника может быть сформирован внутри из медных проводов или другого типа металлического материала, покрытого изолирующей поверхностью.
Кроме того, в зависимости от конфигурации схемы можно различать жилы для жилых помещений (тонкие) или кабели для подземных ответвлений в электрических распределительных системах (толстые).
В рамках данной статьи мы сосредоточимся на характеристиках проводящих материалов в чистом виде; Кроме того, мы узнаем, какие токопроводящие материалы сегодня используются наиболее часто и почему.
Пробой диэлектрика
Помните мы в данной статье уже говорили о том, что у каждого диэлектрика есть свой предел и что нельзя однозначно называть вещество диэлектриком и нужно рассматривать его в динамике. Так вот, давайте вернемся к этой теме и немного углубимся в нее. Знаете ли вы, что происходит при поляризации?
Дело в том, что при этом явлении начинается такое состояние, называемое стационарным или же квазистанционырным, если воздействие напряжения извне переменное. Такое состояние отличается от обычного тем, что значения поляризации могут очень долго держаться на одном уровне. Вместе с ними стабилизируется и электропроводность.
Если сразу же начать увеличивать напряженность в таком поле, то можно будет очень точно определить тот предел, при котором эта самая стабильность будет резко нарушаться. Сразу же увеличиться ток, электропроводность, а это уже прямой путь из диэлектрика в проводники. Действительно, после этого вещество уже нельзя охарактеризовать, как диэлектрик. Такой процесс перехода диэлектрика в проводники называется пробоем диэлектрика.
Когда мы поняли, что такое пробой, давайте теперь поймем, как можно легко определить, в какой момент пробой диэлектрика происходит
Как мы можем понять, временной порог пробоя может зависеть от температуры, агрегатного состояния вещества и многих других факторов, тут важно другое. Давайте разберем основные случаи пробоя, их всего лишь два, поэтому не пугайтесь:
- тепловые явления, при которых возрастающая электропроводность обуславливается тем, что диэлектрик очень быстро нагревается, из-за чего стационарным тепловое состояние уже быть не может
- электрические явления, которые происходят из-за увеличения количества свободных электронов и ионов. Это тоже происходит в двух случаях. Либо появление свободных зарядов обусловлено сбитием их другими движущимися зарядами, либо сбитием полем.
Хорошая проводимость
Электрические проводники должны иметь хорошую электропроводность, чтобы выполнять свою функцию по передаче электроэнергии.
Международная электротехническая комиссия в середине 1913 года определила, что электропроводность меди в чистом виде может служить эталоном для измерения и сравнения электропроводности других проводящих материалов.
Таким образом, Международный стандарт на отожженную медь (Международный стандарт отожженной меди, IACS для его аббревиатуры на английском языке).
В качестве эталона была принята проводимость отожженной медной проволоки длиной один метр и массой одного грамма при 20 ° C, значение которой равно 5,80 x 10.7 Вы-1. Это значение известно как 100% -ная электрическая проводимость IACS, и оно является эталоном для измерения проводимости проводящих материалов.
Электропроводящий материал считается таковым, если он имеет более 40% IACS. Материалы с проводимостью более 100% IACS считаются материалами с высокой проводимостью.
Строение электронной оболочки
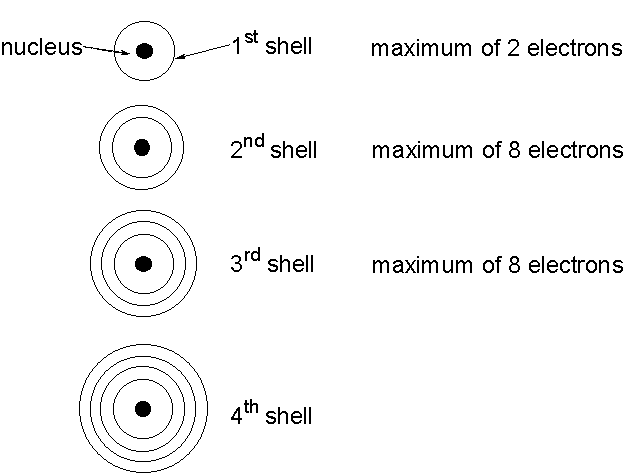
Согласно квантовой модели строение атома Нильса Бора, электроны в атоме могут двигаться только по определенным (стационарным) орбитам, удаленным от ядра на определенное расстояние и характеризующиеся определенной энергией. Другое название стационарны орбит — электронные слои или энергетические уровни.
Электронные уровни можно обозначать цифрами — 1, 2, 3, …, n. Номер слоя увеличивается мере удаления его от ядра. Номер уровня соответствует главному квантовому числу n.
В одном слое электроны могут двигаться по разным траекториям. Траекторию орбиты характеризует электронный подуровень. Тип подуровня характеризует орбитальное квантовое число l = 0,1, 2, 3 …, либо соответствующие буквы — s, p, d, g и др.

В рамках одного подуровня (электронных орбиталей одного типа) возможны варианты расположения орбиталей в пространстве. Чем сложнее геометрия орбиталей данного подуровня, тем больше вариантов их расположения в пространстве. Общее число орбиталей подуровня данного типа l можно определить по формуле: 2l+1. На каждой орбитали может находиться не более двух электронов.
| Тип орбитали | s | p | d | f | g |
| Значение орбитального квантового числа l | 1 | 2 | 3 | 4 | |
| Число атомных орбиталей данного типа 2l+1 | 1 | 3 | 5 | 7 | 9 |
| Максимальное количество электронов на орбиталях данного типа | 2 | 6 | 10 | 14 | 18 |
Получаем сводную таблицу:
|
Номер уровня, n |
Подуровень |
Число
АО |
Максимальное количество электронов |
| 1 | 1s | 1 | 2 |
| 2 | 2s | 1 | 2 |
| 2p | 3 | 6 | |
|
3 |
3s | 1 | 2 |
| 3p | 3 | 6 | |
| 3d | 5 | 10 | |
|
4 |
4s | 1 | 2 |
| 4p | 3 | 6 | |
| 4d | 5 | 10 | |
| 4f | 7 |
14 |
Заполнение электронами энергетических орбиталей происходит согласно некоторым основным правилам. Давайте остановимся на них подробно.
Принцип Паули (запрет Паули): на одной атомной орбитали могут находиться не более двух электронов с противоположными спинами (спин — это квантовомеханическая характеристика движения электрона).
Правило Хунда. На атомных орбиталях с одинаковой энергией электроны располагаются по одному с параллельными спинами. Т.е. орбитали одного подуровня заполняются так: сначала на каждую орбиталь распределяется по одному электрону. Только когда во всех орбиталях данного подуровня распределено по одному электрону, занимаем орбитали вторыми электронами, с противоположными спинами.
Таким образом, сумма спиновых квантовых чисел таких электронов на одном энергетическом подуровне (оболочке) будет максимальной.
Например, заполнение 2р-орбитали тремя электронами будет происходить так: , а не так:
Принцип минимума энергии. Электроны заполняют сначала орбитали с наименьшей энергией. Энергия атомной орбитали эквивалентна сумме главного и орбитального квантовых чисел: n + l. Если сумма одинаковая, то заполняется первой та орбиталь, у которой меньше главное квантовое число n.
| АО | 1s | 2s | 2p | 3s | 3p | 3d | 4s | 4p | 4d | 4f | 5s | 5p | 5d | 5f | 5g |
| n | 1 | 2 | 2 | 3 | 3 | 3 | 4 | 4 | 4 | 4 | 5 | 5 | 5 | 5 | 5 |
| l | 1 | 1 | 2 | 1 | 2 | 3 | 1 | 2 | 3 | 4 | |||||
| n + l | 1 | 2 | 3 | 3 | 4 | 5 | 4 | 5 | 6 | 7 | 5 | 6 | 7 | 8 | 9 |
Таким образом, энергетический ряд орбиталей выглядит так:
1s < 2s < 2 p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 4f~5d < 6p < 7s <5f~6d …
Электронную структуру атома можно представлять в разных формах — энергетическая диаграмма, электронная формула и др. Разберем основные.
Энергетическая диаграмма атома — это схематическое изображение орбиталей с учетом их энергии. Диаграмма показывает расположение электронов на энергетических уровнях и подуровнях. Заполнение орбиталей происходит согласно квантовым принципам.
Например, энергетическая диаграмма для атома углерода:
Электронная формула — это запись распределения электронов по орбиталям атома или иона. Сначала указывается номер уровня, затем тип орбитали. Верхний индекс справа от буквы показывает число электронов на орбитали. Орбитали указываются в порядке заполнения. Запись 1s2 означает, что на 1 уровне s-подуровне расположено 2 электрона.
Например, электронная формула углерода выглядит так: 1s22s22p2.
Для краткости записи, вместо энергетических орбиталей, полностью заполненных электронами, иногда используют символ ближайшего благородного газа (элемента VIIIА группы), имеющего соответствующую электронную конфигурацию.
Например, электронную формулу азота можно записать так: 1s22s22p3 или так: 2s22p3.
1s2 =
1s22s22p6 =
1s22s22p63s23p6 = и так далее.
Что будет, если воздействовать извне?
Если приложить к электрическому диэлектрику внешнее электрическое поле, то свободные заряды диэлектрика начнут постепенно нейтрализовывать его. Причем, это будет происходить до тех пор, пока не закончатся электроны или результирующее поле не станет равным нулю.
Чтобы понять то какие вещества вообще могут взаимодействовать с электрическими полями, нам нужно разобраться в таком термине, как электропроводность. Если говорить простым языком, то для взаимодействия с электрическим полем у вещества должна быть довольно низкая электропроводность.
Если мы будем говорить точнее, то удельное сопротивление должно быть сравнимо с 1010 Q-см или даже сильно превосходило это значение.
Помещаем в постоянное поле
Теперь давайте немного отойдем от того, какие вещества могут быть диэлектриками и какие не могут ими быть, тем более что мы уже достаточно хорошо разобрались в этом вопросе.

Давайте попробуем сейчас ответить на такой интересный вопрос: что же будет, если диэлектрик поместить в постоянное электрическое поле? Сначала давайте дадим краткий ответ, а потом уже разберемся в этом вопросе более подробно. Так вот, если поместить диэлектрик в электрическое поле, то заряды диэлектрика, из которых он состоит будут под воздействием некоторых сил, которые будут:
- смещать связанные заряды (это только электроны и ионы)
- накладывать на беспорядочное движение тепла поля, которое будет это движение упорядочивать (положительные заряды будут идти в одну сторону с полем, а отрицательные — в обратную)
Что будет давать упорядоченное перемещение
При упорядочивании зарядов диэлектрика есть целых два варианта развития событий:
- новое равновесное состояние с другим распределением зарядов, причем движение сразу прекращается при достижении равновесия
- пока поле будет действовать, упорядочивание может длится, пока в нем еще останутся свободные электроны или свободные ионы, о которых мы поговорили выше
Окисление
Степень окисления — заряд элемента, находящегося в соединении, который вычислен путем того, что в соединении ковалентная полярная связь превратилась в ионную.
Окисление — важная часть в образовании новых соединений.
Частицы в реакциях
Когда происходит химическая реакция, электроны либо объединяются, либо переходят к более отрицательному атому, чтобы стать заряженными.
Если бы вещества состояли только из ионов, то их заряды имели целые числа, которые равнялись бы количеству электронов (отданных или не отданных). Рассмотрим хлорид натрия (NaCl). Хлор (Cl) отнимает у натрия (Na) один электрон, при этом два элемента становятся ионами, но с разными зарядами. Натрий (Na) становится положительным, то есть катионом (записывается Na⁺¹), а хлор (Cl) — отрицательным, то есть анионом (записывается Cl⁻¹). Перейдем к соляной кислоте (HCl).
В этой паре хлор (Cl) считается самым отрицательным в электрическом плане, поэтому все два электрона (от водорода (Н) и от него) больше направлены к хлору (Cl), а если электрон водорода (Н) перейдет к хлору, что заряды будут полными, а не частичными как в первом случае. Правильная запись выглядит вот так: H+1CI-1.
Эти надстрочные значки и являются степенью окисления.
Правила записи степени окисления
Чтобы правильно записать степень окисления, нужно знать несколько правил:
- Степень окисления располагается над элементом справа;
- Первым делом записывается знак заряда (плюс или минус), не записывать его нельзя, это считается грубой ошибкой;
- После знака следует само значение;
- Даже если степень окисления равна +1 или -1, то она так и записывается без сокращения ( с сокращением, то есть + или -, пишутся только ионы);
- Заряд ионов записывается над ними справа;
- На первом месте в написании заряда стоит значение, а уже только потом знак.
Пример степени окисления: H+2O-2
Пример заряда иона: AL3+ii.
Вычисление степени окисления
Вычисление степени окисления проводится по некоторым пунктам, которых стоит придерживаться:
1.Есть элементы, у которых степень окисления неизменна, к ним относятся:
- щелочные металлы (степень окисления всегда +1);
- металлы из 2А группы (+2);
- алюминий (FI+3) и бор (B+3);
- фтор (F-1);
- часто кислород (О) имеет степень окисления — 2, но есть исключение у пероксидов, где у кислорода (О) -1;
- водород (Н). С неметаллами его степень равна +1, с металлами — -2.
2. Остальное в периодической таблице с плавающей степенью. Если рассмотреть хлор (Cl), то его значения нечетны: начиная от -1, заканчивая +7 (сюда входит +1, +3, +5). А вот у серы (S) все наоборот — она имеет лишь четные: от -2 до +6 (входит +2, +4).
Главное правило: если сложить все степени из соединения, то должен получиться ноль. Также, если состав какого-либо вещества из одного элемента, то его степень будет нулем.
Бывает такое, что соединение из трех составляющих. Ни в коем случае нельзя делать так, как в соединении двух элементов. Значение первого и последнего элементов известны, а значение третьего нужно считать по специальной формуле.
Пример
Возьмем Н3РО4 (фосфорная кислота).
Из правила водород (Н) будет +1, а кислород (О) — -2, осталось узнать о фосфоре (Р). Мы должны сложить все известные значения.
Здесь будем использовать уравнение.
(+1) × 3 + Х + (-2) × 4 = 0
Х = +5
Мы знаем, что сумма всех элементов должна быть нулем, поэтому приравниваем весь пример ему. Перед водородом (Н) стоит цифра 3, поэтому его степень умножаем на это число, то же самое и с кислородом (О). Фосфор (Р) у нас неизвестен, поэтому обозначаем его иксом. Дальше решаем обычным уравнением и вписываем полученное значение над ним.
Если говорить про степень окисления и валентность, то это абсолютно разные вещи. Первое имеет отрицательное или нулевое значения, а второе только положительное.
Электронные формулы элементов первых четырех периодов
Рассмотрим заполнение электронами оболочки элементов первых четырех периодов. У водорода заполняется самый первый энергетический уровень, s-подуровень, на нем расположен 1 электрон:
+1H 1s1 1s
У гелия 1s-орбиталь полностью заполнена:
+2He 1s2 1s
Поскольку первый энергетический уровень вмещает максимально 2 электрона, у лития начинается заполнение второго энергетического уровня, начиная с орбитали с минимальной энергией — 2s. При этом сначала заполняется первый энергетический уровень:
+3Li 1s22s1 1s 2s
У бериллия 2s-подуровень заполнен:
+4Be 1s22s2 1s 2s
Далее, у бора заполняется p-подуровень второго уровня:
+5B 1s22s22p1 1s 2s 2p
У следующего элемента, углерода, очередной электрон, согласно правилу Хунда, заполняет вакантную орбиталь, а не заполняет частично занятую:
+6C 1s22s22p2 1s 2s 2p
Попробуйте составить электронную и электронно-графическую формулы для следующих элементов, а затем можете проверить себя по ответам конце статьи:
5. Азот
6. Кислород
7. Фтор
У неона завершено заполнение второго энергетического уровня:
+10Ne 1s22s22p6 1s 2s 2p
У натрия начинается заполнение третьего энергетического уровня:
+11Na 1s22s22p63s1 1s 2s 2p 3s
От натрия до аргона заполнение 3-го уровня происходит в том же порядке, что и заполнение 2-го энергетического уровня. Предлагаю составить электронные формулы элементов от магния до аргона самостоятельно, проверить по ответам.
8. Магний
9. Алюминий
10. Кремний
11. Фосфор
12. Сера
13. Хлор
14. Аргон
А вот начиная с 19-го элемента, калия, иногда начинается путаница — заполняется не 3d-орбиталь, а 4s. Ранее мы упоминали в этой статье, что заполнение энергетических уровней и подуровней электронами происходит по энергетическому ряду орбиталей, а не по порядку. Рекомендую повторить его еще раз. Таким образом, формула калия:
+19K 1s22s22p63s23p64s11s 2s 2p3s 3p4s
Для записи дальнейших электронных формул в статье будем использовать сокращенную форму:
+19K 4s1 4s
У кальция 4s-подуровень заполнен:
+20Ca 4s2 4s
У элемента 21, скандия, согласно энергетическому ряду орбиталей, начинается заполнение 3d-подуровня:
+21Sc 3d14s2 4s 3d
Дальнейшее заполнение 3d-подуровня происходит согласно квантовым правилам, от титана до ванадия:
+22Ti 3d24s2 4s 3d
+23V 3d34s2 4s 3d
Однако, у следующего элемента порядок заполнения орбиталей нарушается. Электронная конфигурация хрома такая:
+24Cr 3d54s1 4s 3d
В чём же дело? А дело в том, что при «традиционном» порядке заполнения орбиталей (соответственно, неверном в данном случае — 3d44s2) ровно одна ячейка в d-подуровне оставалась бы незаполненной. Оказалось, что такое заполнение энергетически менее выгодно. А более выгодно, когда d-орбиталь заполнена полностью, хотя бы единичными электронами. Этот лишний электрон переходит с 4s-подуровня. И небольшие затраты энергии на перескок электрона с 4s-подуровня с лихвой покрывает энергетический эффект от заполнения всех 3d-орбиталей. Этот эффект так и называется — «провал» или «проскок» электрона. И наблюдается он, когда d-орбиталь недозаполнена на 1 электрон (по одному электрону в ячейке или по два).
У следующих элементов «традиционный» порядок заполнения орбиталей снова возвращается. Конфигурация марганца:
+25Mn 3d54s2
Аналогично у кобальта и никеля. А вот у меди мы снова наблюдаем провал (проскок) электрона — электрон опять проскакивает с 4s-подуровня на 3d-подуровень:
+29Cu 3d104s1
На цинке завершается заполнение 3d-подуровня:
+30Zn 3d104s2
У следующих элементов, от галлия до криптона, происходит заполнение 4p-подуровня по квантовым правилам. Например, электронная формула галлия:
+31Ga 3d104s24p1
Формулы остальных элементов мы приводить не будем, можете составить их самостоятельно.
Некоторые важные понятия:
Внешний энергетический уровень — это энергетический уровень в атоме с максимальным номером, на котором есть электроны.
Например, у меди (3d104s1) внешний энергетический уровень — четвёртый.
Валентные электроны — электроны в атоме, которые могут участвовать в образовании химической связи. Например, у хрома (+24Cr 3d54s1) валентными являются не только электроны внешнего энергетического уровня (4s1), но и неспаренные электроны на 3d-подуровне, т.к. они могут образовывать химические связи.
Энергии подоболочки и порядок заполнения
Для многоэлектронных атомов n — плохой индикатор энергии электрона. Энергетические спектры некоторых оболочек чередуются.
Состояния, перечеркнутые одинаковой красной стрелкой, имеют одинаковое значение. Направление красной стрелки указывает порядок заполнения состояний.п+ℓ{\ Displaystyle п + \ ell}
Хотя иногда говорят, что все электроны в оболочке имеют одинаковую энергию, это приближение. Однако электроны в одной подоболочке действительно имеют точно такой же уровень энергии, а более поздние подоболочки имеют больше энергии на электрон, чем более ранние. Этот эффект настолько велик, что диапазоны энергии, связанные с оболочками, могут перекрываться.
Заполнение оболочек и подоболочек электронами происходит от подоболочек с меньшей энергией к подоболочкам с более высокой энергией. Это соответствует правилу n + ℓ, которое также широко известно как правило Маделунга. Подоболочки с меньшим значением n + ℓ заполняются раньше, чем с более высокими значениями n + . В случае равных значений n + ℓ , подоболочка с меньшим значением n заполняется первой.
История
Терминология оболочки взята из модификации модели Бора Арнольдом Зоммерфельдом . Зоммерфельда сохранил планетарную модель Бора, но добавил слабо эллиптические орбиты (характеризующиеся дополнительным квантовые числа л и м ) для объяснения тонких спектроскопической структуры некоторых элементов. Несколько электронов с одним и тем же главным квантовым числом ( n ) имели близкие орбиты, которые образовывали «оболочку» положительной толщины вместо бесконечно тонкой круговой орбиты модели Бора.
Существование электронных оболочек впервые было обнаружено экспериментально в Чарльз Баркла «ы и Мозли » S рентгеновских исследований поглощения. Баркла обозначил их буквами K, L, M, N, O, P и Q. Происхождение этой терминологии было алфавитным. Предполагалась также серия «J», хотя более поздние эксперименты показали, что линии поглощения K создаются самыми внутренними электронами. Позднее было обнаружено, что эти буквы соответствуют значениям n 1, 2, 3 и т. Д. Они используются в спектроскопической нотации Зигбана .
Типы электрических проводников
Существуют разные категории электрических проводников, и, в свою очередь, в каждую категорию входят материалы или среды с наивысшей электропроводностью.
По своему качеству лучшие электрические проводники — это твердые металлы, среди которых выделяются медь, золото, серебро, алюминий, железо и некоторые сплавы.
Однако есть другие типы материалов или растворов, которые обладают хорошими свойствами электропроводности, например графит или солевые растворы.
В зависимости от способа проведения электропроводности можно выделить три типа материалов или проводящих сред, которые подробно описаны ниже:
Аморфные диэлектрики. Какие они?
Чем особенны аморфные диэлектрики? Главное, что отличает их от других — это довольно рыхлая структура, а значит очень много пустот внутри и большое пространство, где ионы могут находится в состоянии равновесия. При этом, при переходе от одного равновесного состояния до другого энергия, расходуемая ионом будет всегда разной. В некоторых переходах ион не будет полностью высвобождаться от сдерживающих его сил, поэтому можно его условно охарактеризовать как наполовину связанный этими силами.

Такие переходы будут тратить очень небольшое количество энергии, и перемещаться ион при таких переходах сможет лишь на очень небольшое расстояние. В результате теплового перемещения такие переходы внутри аморфных тел будут встречаться гораздо чаще, ведь они требуют гораздо меньше энергии, чем другие.
Однако, небольшое количество ионов, которые содержат в себе большие запасы энергии, смогут таки преодолевать связывающие их силы и будут перемещаться на сравнительно большие расстояния.
Кристаллическая решетка поможет разобраться
Сейчас в познании электрических диэлектриков нам поможет разобраться кристаллическая решетка. Для того, чтобы термины не казались нам непонятными, давайте их освежим в своей голове. Кристаллическая решетка — это группа таких точек, которые образуются в веществах (а точнее в кристаллах) под воздействием сдвигов (они, кстати, могут происходить из-за воздействия электрического поля. Отлично, вспомнили. Давайте теперь разбираться.
Как мы помним, в атоме, который в данный момент изолирован, энергия электронов не может принимать какие угодно значения. В таком состоянии энергия будет принимать четко обозначенные значение W1, W2, W3 и т.д. Вот, взгляните на график:
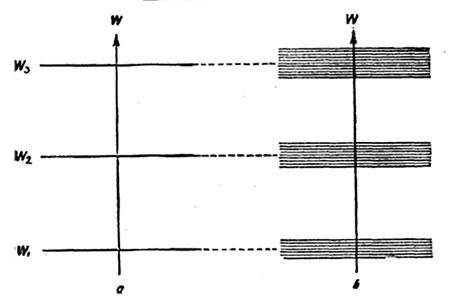
Конечно же, каждый из этих уровней будет немного смещен после того, как атомы войдут в состав твердой кристаллической решетки. В итоге зона, в которой будет концентрировать вся энергия будет общей для всей решетки.
Итак, в кристаллической решетке энергия электронов лежит в пределах четко определенных зон и все значения, которые находятся вне этой зоны, запрещены. Это мы поняли. Двигаемся дальше. По принципу Паули каждая зона может вместить в себя ограниченное количество электронов. Сначала электроны будут заполнять нижние уровни, а когда эти ряды заполняться полностью, они будут заполнять верхние ряды.
И вот теперь ключевая мысль, которую нужно понять, чтобы разобраться в том, почему те или иные вещества проводят электрический ток. Раз электроны постепенно заполняют ряды от нижнего к верхнему, то на самом верхнем ряду они либо заполнят этот ряд полностью, либо только частично.
Так вот, при частичном заполнении ряда электроны смогут свободно по нему перемещаться, а значит и будут проводить ток. Бинго! А вот в случае, если электроны все-таки заполнят верхний уровень, то при воздействии электрического поля никаких сдвигов не произойдет и, соответственно, такое вещество можно назвать диэлектриком.
Очень похожая ситуация происходит и с аморфными твердыми телами (ну например янтарь или полиэтилен). По определению, у таких веществ расположение атомов очень случайно, а зоны, общие для всего кристалла просто не могут существовать, а значит они тоже электрические диэлектрики.
Заключение
Эта тема переплела два ответвления — физику и химию, показывая всю многогранность нашей природы и взаимосвязь этих наук. Как мы поняли, некоторые моменты до сих пор непонятны нам, но ученые не останавливаются на достигнутом, продвигаясь дальше. Данный предмет обсуждения, находящийся в этой работе — базовые понятия, написанные доступным языком.
Этот материал разбирал такие маленькие, но важные для нас моменты — атомы, которых мы не видим, хотя они влияют на все вокруг, даже на нас самих.
Чтобы лучше усвоить материал, здесь собраны ключевые моменты из текста, требующие особого внимания:
- Вещества бывают простыми и сложными;
- Атомы — это неразлагающиеся мелкие частицы;
- Чем выше порядковый номер у элемента, тем больше его атомный вес;
- Изотопы — химические элементы под одним порядковым номером, но с разной массой ядер. Есть у любого элемента;
- У атомов есть частицы (элементарные): протоны, нейтроны, электроны;
- Протоны — положительно заряженные частицы, находящиеся в ядре;
- Нейтроны — беззарядные частицы;
- Электроны — частицы, с самым маленьким отрицательным электрическим зарядом;
- Значение протона равно значению электрона;
- Чем быстрее скорость электрона, тем его масса больше;
- Движение электрона волнообразное, упорядоченное, при этом он вращается;
- Интерференция электронов — слияние нескольких волн электронов;
- Дифракция электронов — волновое обтекание области места, через которое проходит ток;
- Порядковый номер — это заряд ядра;
- У каждой частицы есть электрическое поле, позволяющее взаимодействовать с другими частицами;
- Фотон — переносчик электромагнитного “общения” частиц;
- Ядерное поле — вид материи, который состоит из протонов, нейтронов и мезонов.
- Мезон — частица, позволяющая протонам и нейтронам контактировать, а также удерживает их внутри ядра ядерной силой;
- Ядерная сила — сила влияния протона и нейтрона друг на друга;
- Ядерные силы могут из протонов нейтроны и наоборот при помощи мезонов;
- Ядерные силы мощнее электрических;
- Протон, нейтрон и электрон называются элементарными, потому что их невозможно разложить на более простые частицы, но они могут становиться друг другом и образовываться друг из друга;
- Если электрон отдалится от ядра, то он ненадолго образует энергию, но все равно вернется на свое место, тоже образовывая энергию, переходящую в излучение;
- Дозволенные слои — орбиты, на которые электрон может переходить;
- Дейтон — объединение протона и нейтрона в ядре;
- Легкие элементы считаются лучше, потому что их ядра прочнее из-за одинакового числа частиц;
- Число электронных слоев = номер периода;
- У каждой электронной оболочки есть определенное конечное число электронов, которое оно способно вместить;
- Те элементы, у которых оболочки не полностью заполнены, лучше вступают в контакт с другими элементами;
- Ион — заряженная молекула.
- Катион — положительный ион.
- Анион — отрицательный ион;
- Степень окисления — заряд элемента, который вычислен путем того, что в соединении ковалентная полярная связь превратилась в ионную;
- Есть элементы, чья степень окисления постоянна, а есть те, у кого она изменяется;
- Если сложить все степени окисления в соединении, то всё будет равно нулю.
Короткое, но познавательное видео про элементарные частицы: